5. Chemische Bindungen
a) Bindungstypen
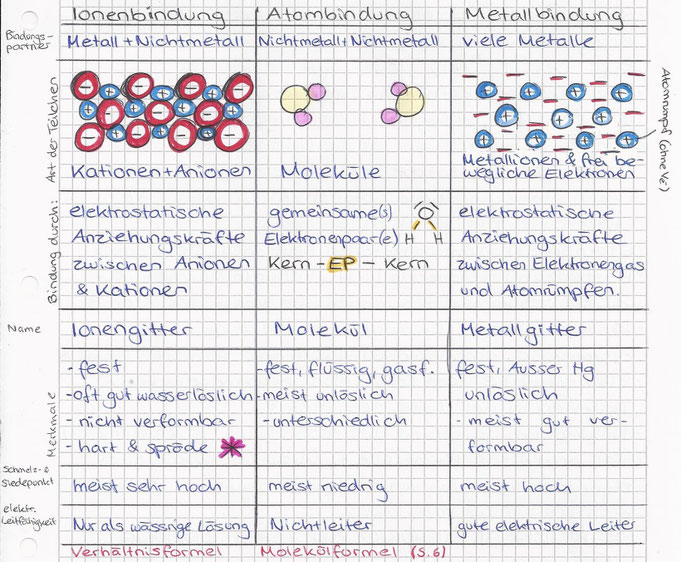

<= Sprödheit von Salzen / Ionengitter (Me + NMe)
durch einen Schlag werden die Reihen der Ionengitter so verschoben, dass positiv auf positiv und negativ auf negativ stösst. Da diese sich abstossen, zerbricht das Gitter, wodurch auch Salz auseinanderfällt unter Krafteinwirkungen.
5 Stoffklassen:
1) flüchtige Stoffe (polar oder unpolar)
2) diamantartige Stoffe (kleinste Teilchen: Riesenmoleküle")
3) hochmolekulare Stoffe (kettenartige Moleküle)
4) salzartige Stoffe (Metall+Nichtmetall)
5) metallische Stoffe (Metall+Metall)
Molekülformel
- Bei Molekülen (Nichtmetall + Nichtmetall)
- Gibt die genaue Anzahl Atome an
Bsp: Wasser (H2O), Ethin (C2H2), CO2
Verhältnisformel
- Bei Salzen (Metall + Nichtmetall)
- Gibt nur das Verhältnis der Atome an, nicht die genaue Anzahl
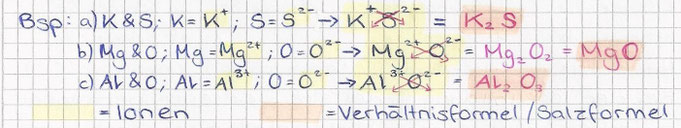
Atome & Ionen
- Enthält ein Teilchen gleich viele Elektronen wie Protonen, so handelt es sich um ein elektrisch neutrales Atom
- Ist dem nicht so, ist es ein geladenes Ion
- Anionen haben mehr Elektronen als Protonen => negativ
- Kationen haben weniger Elektronen als Protonen => positiv

Endotherme Reaktion
Chemische Reaktion, bei denen ständig Energie in Form von Wärme zugeführt werden muss, damit sie ablaufen => fühlt sich kalt an
Exotherme Reaktion
Chemische Reaktionen, bei denen Wärme frei wird
=> fühlt sich warm / heiss an (EXotherm => SEX => heiss)
Elektrostatisches Grundgesetz (Coulombsches Gesetz)

b) Kovalente Bindung
Lewisformel
Alle Atome haben maximal 4 Kugelwolken, ausser jene Atome in der 1. Periode mit 1 Schale:

Elektronegativität (= EN)
Elektronegativität ist ein Mass für die Stärke, mit der ein Atom bindende Elektronen anzieht. Ist im Periodensystem angegeben.


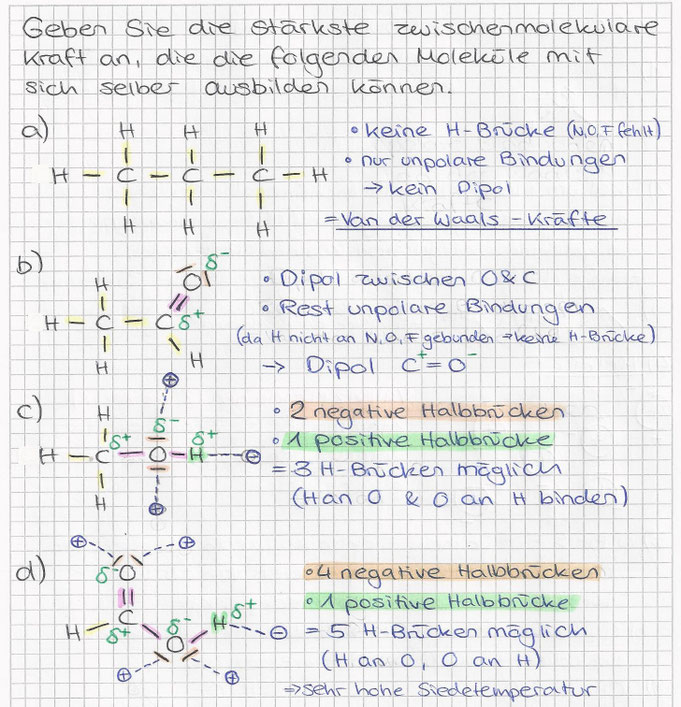
c) Ionenbindung / Salze
Ionenbildung aus Atomen
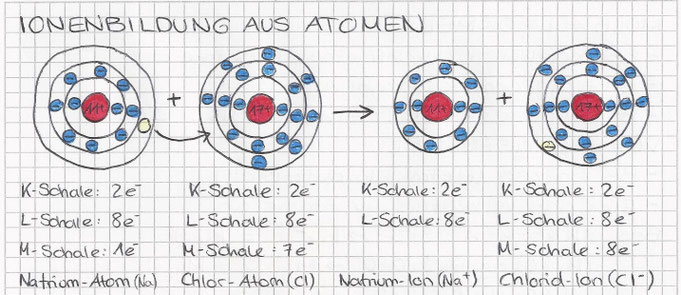
Bei der Ionenbildung findet eine Elektronenübertragung zwischen Metallatom und Nichtmetallatom statt, wobei die Metallatome die Valenzelektronen an die Nichtmetallatome abgeben.
Die gebildeten Ionen besitzen Edelgaskonfigurtionen.
Nomenklatur einfacher Salze
Kationen können Metallkationen oder Molekülkationen sein.
Anionen können Elementanionen oder Molekülanionen sein.
