Säuren & Basen
Definition nach Brönsted
Säuren sind Stoffe, die Wasserstoff-Ionen abzuspalten vermögen. Basen sind Stoffe, die Wasserstoff-Ionen anzulagern vermögen. Da das Wasserstoffion ein einzelnes Proton ist, kann auch gesagt werden:
Säuren sind Protonendonatoren (Donator = Geber)
Basen sind Protonenakzeptoren (Akzeptor = Empfänger)
Säure ![]() Base + Proton
Base + Proton
Wichtigste Säuren und Basen
Säuren
- Ameisensäure (Ameise & Brennnessel)
- Salzsäure (Magensäure)
- Milchsäure (Milch)
- Zitronensäure (Zitrone)
- Kohlensäure (Mineralwasser)...
Basen
Ätzend, schmeckt seifig / nach Laugenbrötchen
färbt Universalindikator blau, fettlösend.
- Natronlauge = Laugenbrötchen
- Ammoniak (NH3) = Fensterreiniger
Reaktionsgleichungen
Säure mit Wasser
Das dabei entstehende Säureteilchen ist H3O+
HBr + H2O => H3O+ + Br-
HNO3 + H2O => H3O+ + NO3-
H2SO4 + H2O => H3O+ + HSO4-
HClO4 + H2O => H3O+ + ClO4-
Säuren zersetzen Metalle, also zum Herausfinden entweder ein Metall hineingeben oder einen Indikator benutzen.
Säuren sind Molekülverbindungen.
Base mit Wasser
Das dabei entstehende Baseteilchen ist
OH-
NH3 + H2O => NH4 + OH-
NaOH + H2O => Na+ + OH-
Ca(OH)2 + H2O => Ca2+ + 2OH-
KOH + H2O => K+ + OH-
Mg(OH)2 + H2O => Mg2+ + 2OH-
Base herausfinden: 1. Typ: Ammoniak: NH3
2. Typ: Metall(OH) => Metallhydroxid
= Mg(OH)2, NaOH
Säure-Basen-Reaktion in Wasser
NH3 + HCl => NH4+Cl- / NH4Cl
Base + Säure => Salz
NaOH + HCl => Na+Cl- / NaCl + H2O
Base + Säure => Salz + Wasser
KOH + HNO3
=> KNO3 + H2O
NaOH + HCOOH => Na+HCOO- / NaHCOO + H2O
Ca(OH)2 + H2O => Ca2+2OH- / CaOH2
Neutralisation
H3O+ + OH- => H2O + H2O
pH - Skala
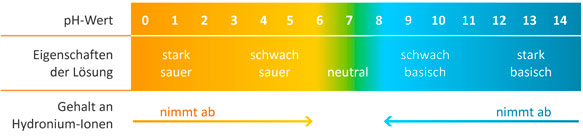
Der pH-Wert gibt an, wie stark sauer oder alkalisch eine Lösung ist.
Bei der pH-Messung wird die Konzentration von H3O+-Ionen gemessen.
Der pH-Wert ist der negative Zehnerlogarithmus der in mol/L angegebenen H3O+- Konzentration:
pH = -log c ( H3O+) für Säuren pOH = -log c (OH-) für Basen
=> pH + pOH = 14
Übungen pH-berechnen
1. Wie gross ist die Konzentration H3O+-Ionen, wenn 0,1 mol Chlorwasserstoff HCl in einen Liter Wasser gelöst wird und HCl mit Wasser vollständig reagiert?
a) Wie lautet die Reaktionsgleichung?
b) Wie gross ist der pH-Wert dieser Salzsäure-Lösung c(HCl) = 0,1 mol/L?
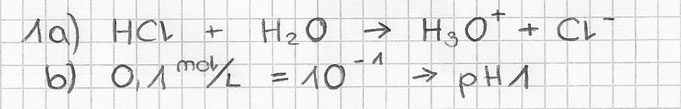
2. Eine Salpetersäure-Lösung hat den pH-Wert = 2,5
a) Reaktionsgleichung
b) Wie gross ist die Konzentration der H3O+-Ionen in mol/L der Lösung?
c) Wie viel Gramm Salpetersäure sind in einem Liter der Lösung vorhanden?
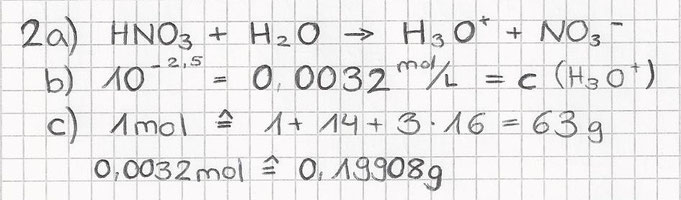
3. in 3 Liter einer Lösung sind 45g Perchlorsäure HClO4 gelöst. Welcher pH-Wert hat die Lösung?
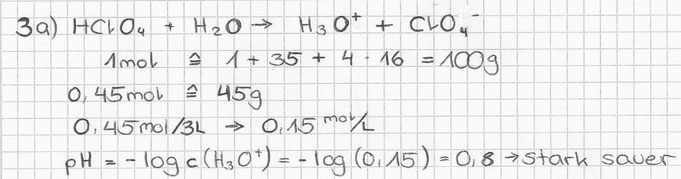
4. Es werden 2 Liter einer Salzsäure-Lösung mit c(HCl) = 0,05 mol/l mit 3 Liter einer Salzsäure-Lösung mit c(HCl) = 0,1 mol/l vermischt. Wie gross ist die Salzsäure-Konzentration nach dem Mischen und welchen pH-Wert hat die Salzsäure-Lösung?

5. Wie gross ist der pH-Wert einer Lösung, wenn 5g Schwefelsäure in 500ml Wasser gelöst werden und folgende Reaktion stattfindet: H2SO4 + 2 H2O => 2H3O+ + (SO4)2-
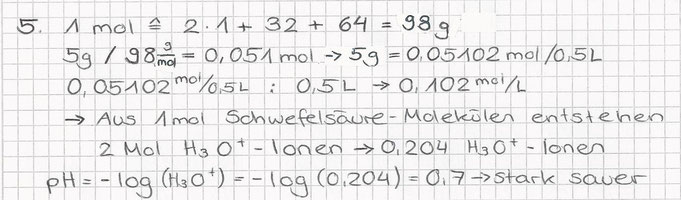
Übungen pOH
1. Wie gross ist die Konzentration von einer Natronlauge mit pH= 13?
=> pH 13 = 10-13 => pOH = 10-1 => pOH = 1
2. Wie gross ist die Konzentration der OH- / H3O+-Ionen bei pH = 13?
=> H3O+ =
Säureteilchen => pH 13 = 10-13 mol/l
=> OH- = Baseteilchen =>
pOH 1 = 10-1 mol/l
